
Números de Oxidación MÁS QUE APUNTES
Esta tabla nos permite entender mejor las interacciones entre los elementos y también nos proporciona información sobre la estructura y la naturaleza de los elementos. Para comprender mejor la tabla periódica, es importante conocer los diferentes tipos de elementos. Estos incluyen los metales, los no metales, los semimetales y los gases nobles.

Quimica 2.2.5 Número de oxidación.
Ejemplos de números de oxidación. Veamos ejemplos específicos de números de oxidación en diferentes compuestos. 1. Ácido clorhídrico (HCl): el número de oxidación del cloro es -1. 2. Sulfato de sodio (Na2SO4): el número de oxidación del azufre es +6. 3. Óxido de hierro (Fe2O3): el número de oxidación del hierro es +3.

numero de oxidacion de los elementos de la tabla periodica Brainly.lat
Esta tabla es una herramienta invaluable que puedes utilizar como referencia para determinar los números de oxidación en reacciones químicas. Aplicaciones prácticas de los números de oxidación. Los números de oxidación tienen múltiples aplicaciones prácticas en la química. Estos nos permiten predecir la dirección de una reacción.

QUIMICAGIMNASIANO TABLA CON NÚMEROS DE OXIDACIÓN GRADO OCTAVO (IMPRIMIR)
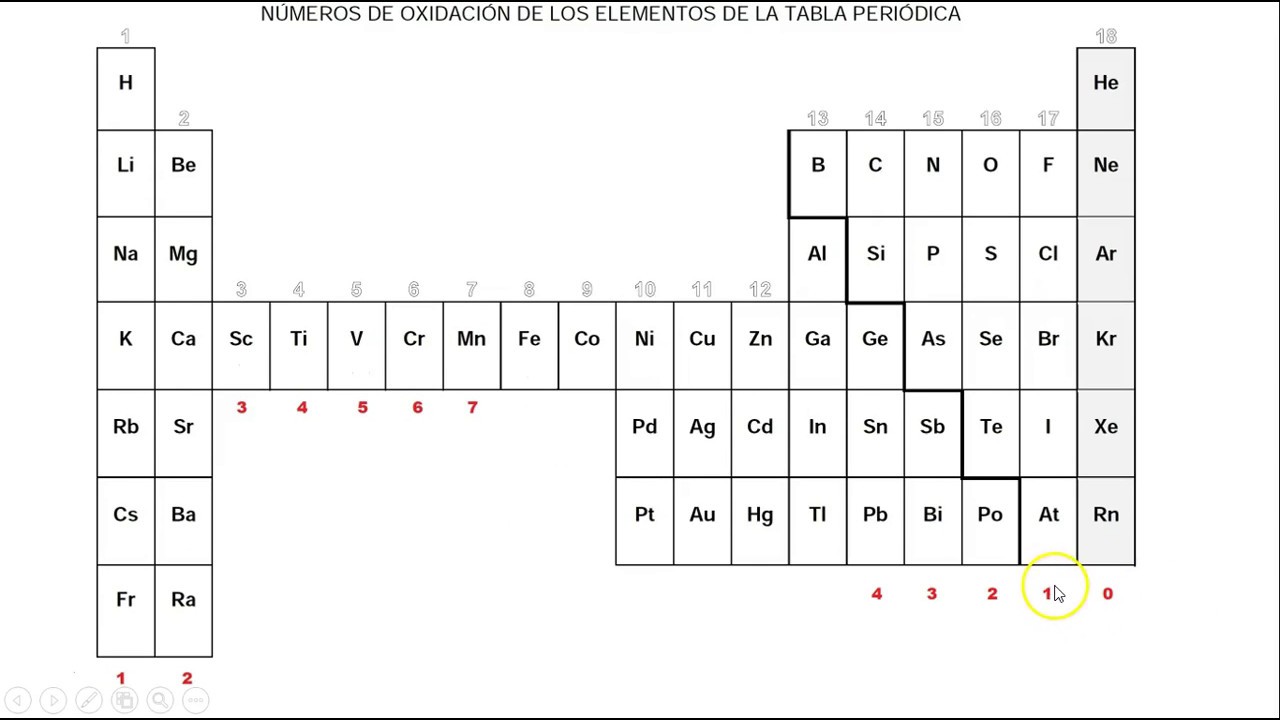
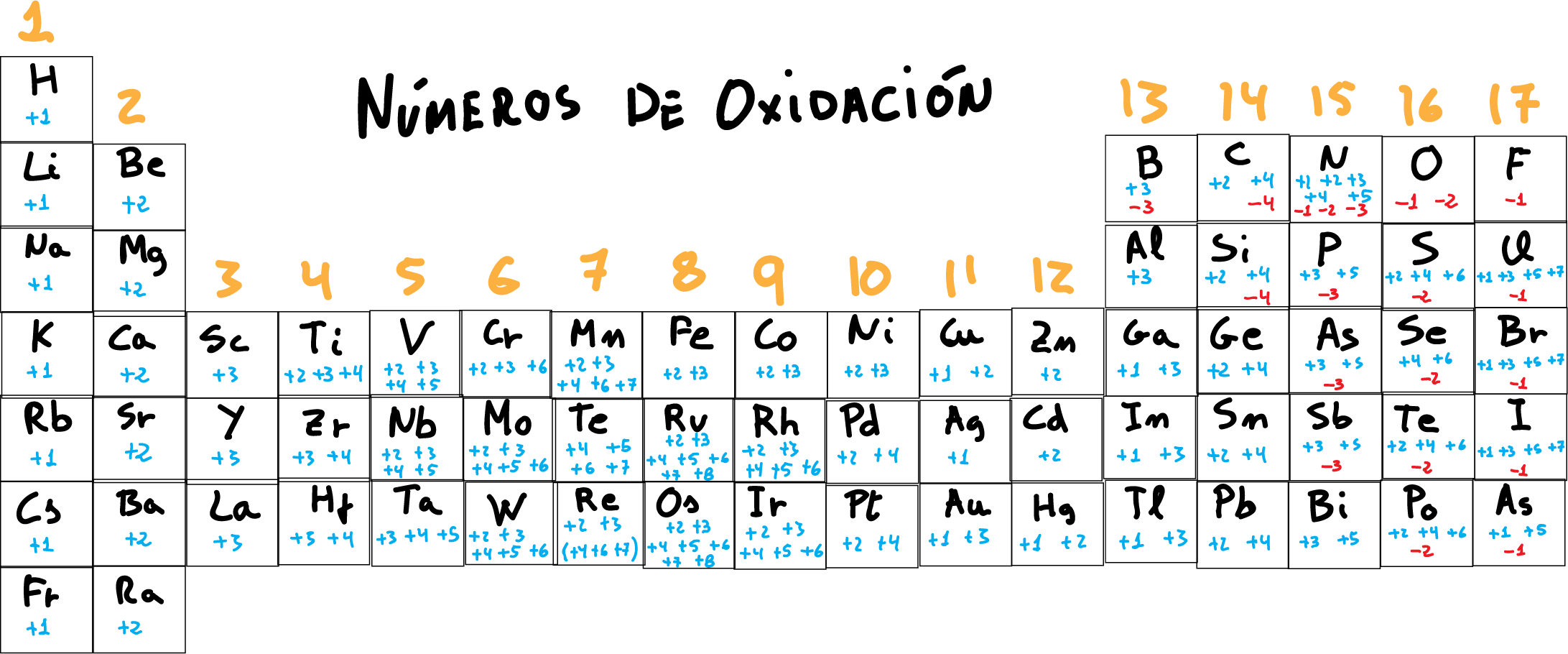
Tabla periódica con los números de oxidación En la siguiente figura se recopilan los números de oxidación del los elementos de la tabla periódica . Como característica general, los átomos alcalinos (grupo 1) presentan carga +1 , los alcalino-terreos (grupo 2), numero de oxidación +2 , y los halógenos cuando tienen número de oxidación negativo de -1 .
APRENDER LOS NÚMEROS DE OXIDACIÓN FÁCILMENTE YouTube
Nota. Las masas atómicas de isótopos son cercanas pero no iguales a sus números de masa. Por ejemplo, \(\ce{^35_17Cl}\) tiene número de masa masa = 35, pero la masa atómica de este isótopo es 34.969 amu como se muestra en el ejemplo anterior. La masa atómica promedio ponderada suele estar más cerca del número de masa del isótopo más abundante, por ejemplo, 35.45 amu en el ejemplo.
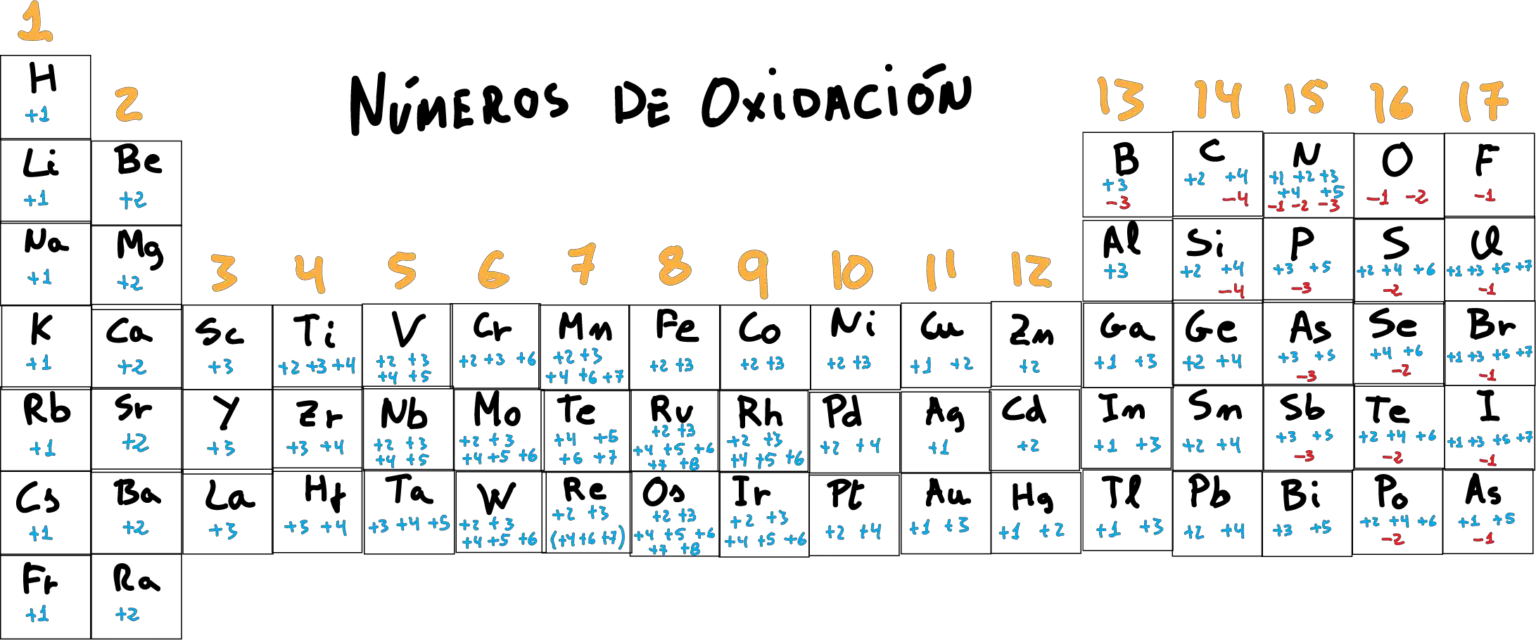
Número de Oxidación Definición, Cálculo De Química
Descubra los secretos de la tabla periódica con números de oxidación. La tabla periódica es una herramienta práctica para comprender la química. Está diseñada para mostrarnos la estructura de los elementos y cómo se relacionan entre sí. Los números de oxidación son una parte importante de la tabla periódica que nos ayuda a entender.

Nomenclatura de los Compuestos Tabla números de oxidación
Fr. +1. Ra. +2. * Los números de oxidación que aparecen entre paréntesis son con los que actúan cuando forman compuestos ternarios, actuando como no metales. ** El oxígeno solo funciona con el número de oxida. ción -1 en los peróxidos. *** Los no metales, cuando se combinan con el hidrógeno, actúan con el número de oxidación.
Números de oxidación y tabla de iones comunes el átomo
El hidrógeno (H) presenta número de oxidación +1 con los no metales y -1 con los metales. El flúor (F) sólo presenta el número de oxidación -1. El oxígeno (O) presenta el número de oxidación -2, excepto en los peróxidos donde es -1. Los metales alcalinos (grupo 1, o grupo del Li) tienen 1 electrón de valencia, tenderán a.
Número de Oxidación Definición, Cálculo De Química
La masa atómica se enumera en una tabla periódica como un número debajo del símbolo y nombre del elemento, como se ilustra en la Fig. 4.1.2. La masa atómica se enumera como un número sin unidad porque es la masa de un átomo en amu y también es la masa de un mol (masa molar) del átomo en gramos.
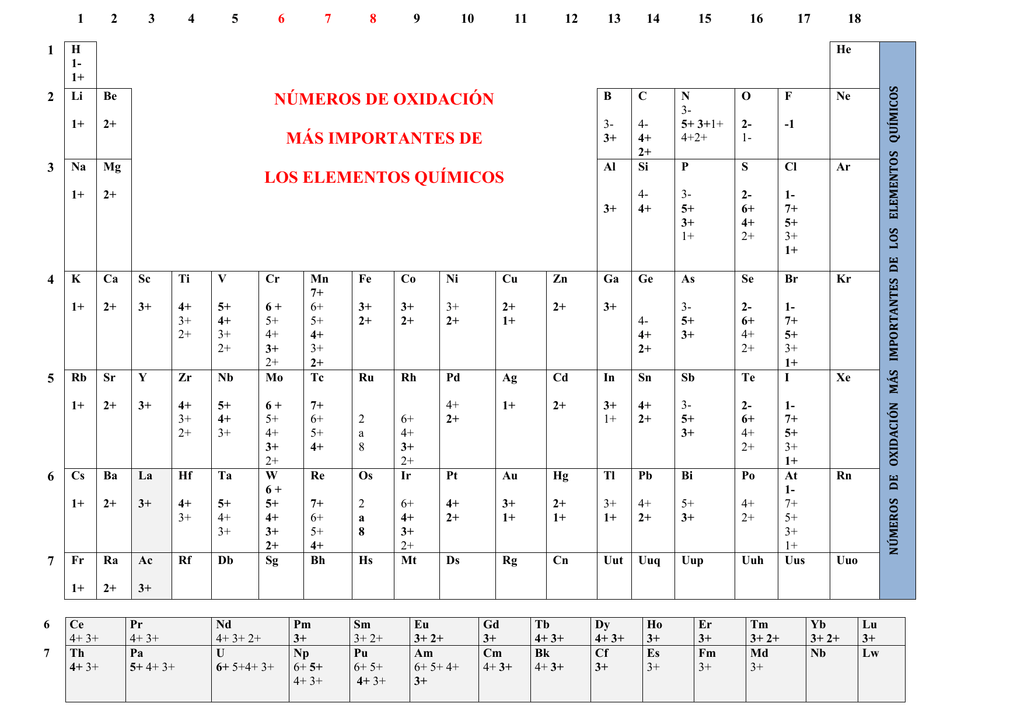
números de oxidación más importantes de los elementos químicos
1.El Número de Oxidación de todos los Elementos en Estado Libre, no combinados con otros, es cero (p. ej., Na, Cu, Mg, H2, O2, Cl2, N2). 2. El Número de Oxidación del Hidrógeno (H) es de +1, excepto en los hidruros metálicos (compuestos formados por H y algún metal), en los que es de -1 (p. ej., NaH, CaH2).
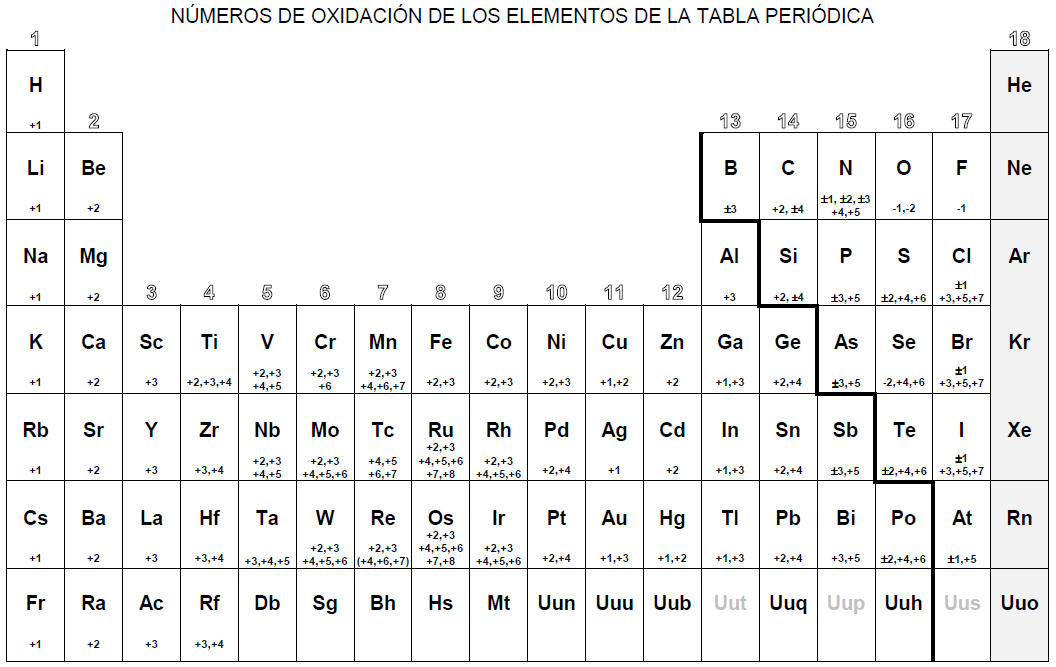
numero de oxidacion
Por ejemplo, el hierro común tiene un número de oxidación de +2 o +3. Los halógenos, por otro lado, tienen un estado de oxidación de -1. Esta tabla periódica contiene los números de oxidación de los elementos, así como los números, símbolos, nombres y pesos atómicos de los elementos.

Resultado de imagen para tabla periodica completa con numeros de oxidacio… Tabla periodica de
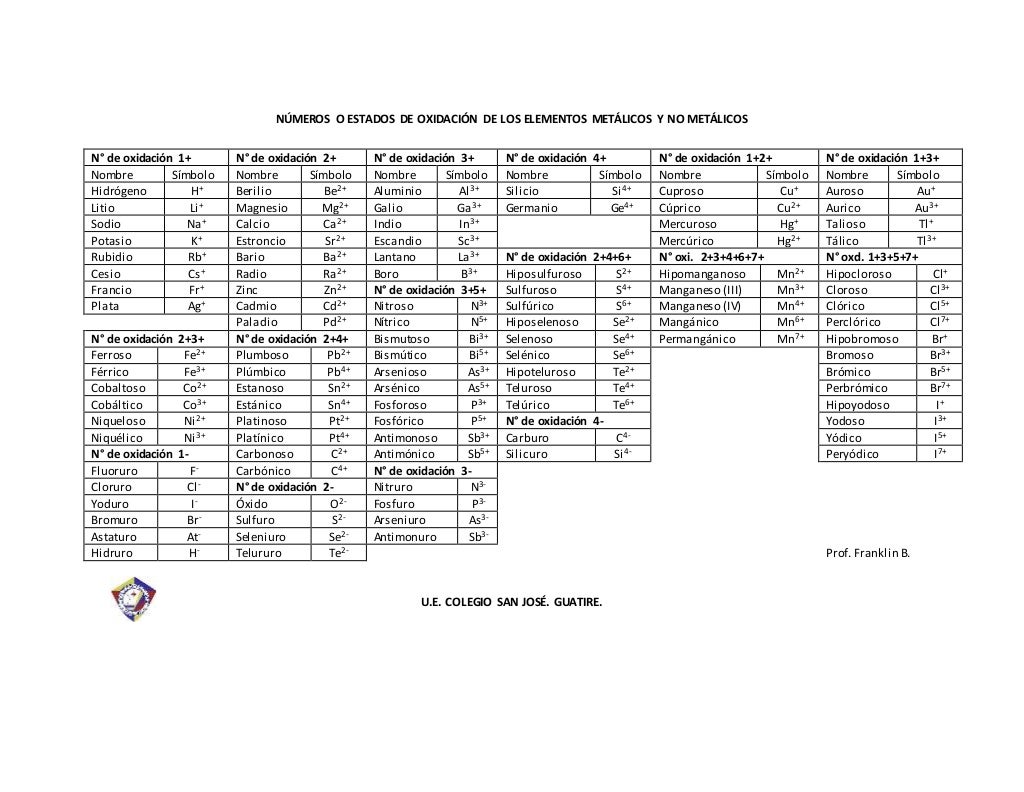
TABLA NÚMEROS DE OXIDACIÓN ELEMENTO SÍMBOLO QUÍMICO Nº DE OXIDACIÓN Actinio Ac + 3 Aluminio Al + 3 Antimonio Sb 3, + 5 Arsénico As 3, + 5 Azufre S 2, + 4 , + 6 Bario Ba + 2 Berilio Be + 2 Bismuto Bi + 3 , + 5 Boro B + 3 Bromo Br 1 , + 3 , + 5 , + 7 Cadmio Cd + 2 Calcio Ca + 2 Carbono

FÍSICA Y QUÍMICA "IES EUGENIO HERMOSO" Números de Oxidación
CALCULADORA DE NÚMEROS DE OXIDACION. Para calcular de los números de oxidación de los elementos de un compuesto químicos, escribre su fórmula y dale clic en 'Calcular' (por ejemplo: Ca2+, HF2^-, Fe4 [Fe (CN)6]3, NH4NO3, so42-, ch3cooh, cuso4*5h2o ). Fórmula: Cl+1 O-2-. Ver el código HTML.
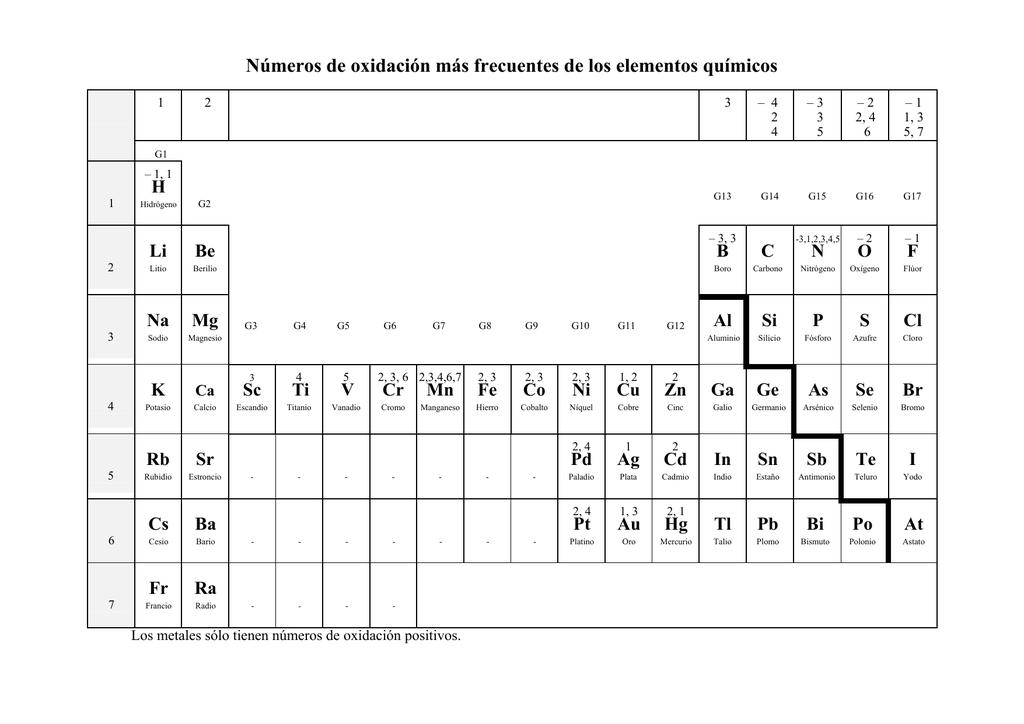
Números de oxidación más frecuentes de los elementos químicos
Los números de oxidación son una herramienta fundamental en la química que nos permite determinar el grado de carga de los átomos en un compuesto. Estos números representan la cantidad de electrones que un átomo ha ganado o perdido en una reacción química. Conocer los números de oxidación es esencial para comprender y predecir el.
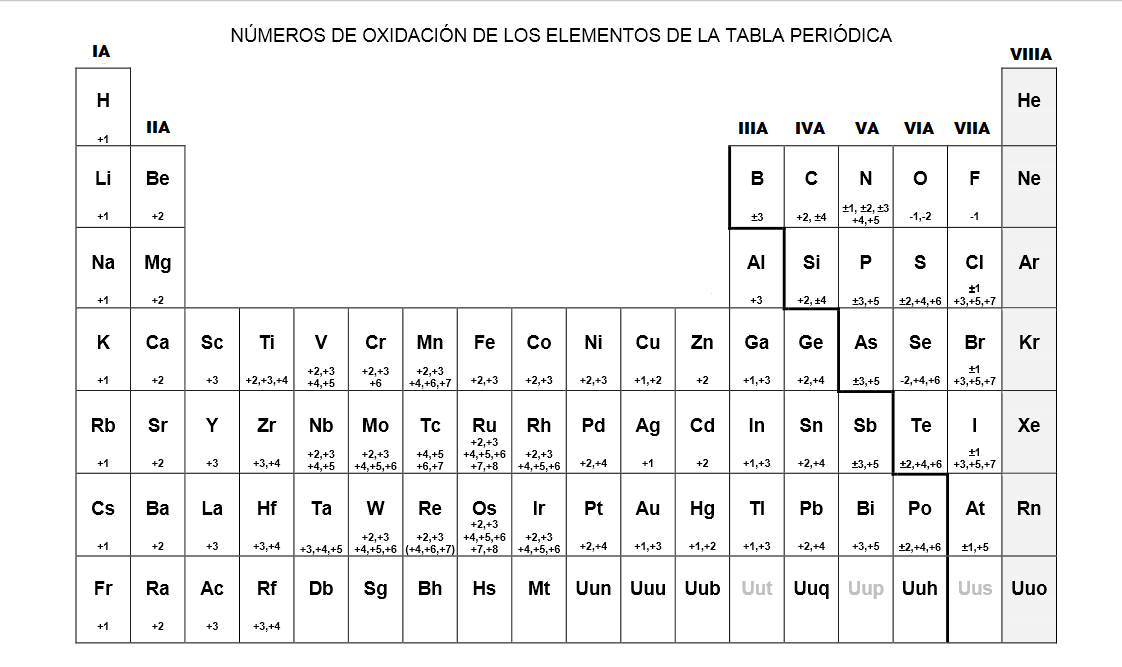
Nomenclatura de los Compuestos Tabla números de oxidación
Aprende gratuitamente sobre matemáticas, arte, programación, economía, física, química, biología, medicina, finanzas, historia y más. Khan Academy es una organización sin fines de lucro, con la misión de proveer una educación gratuita de clase mundial, para cualquier persona en cualquier lugar.

Tabla Numeros de Oxidacion PDF PDF
En la tabla tienes los números de oxidación más habituales de los elementos. Están relacionados con su situación en la tabla periódica y con las característias de los enlaces que forman, como ya viste en la unidades 1 y 2: por ejemplo, en los alcalinotérreos -grupo 2- es +2 porque como tienen dos electrones en la capa más externa tienen tendencia a perderlos para alcanzar la.